近日,我院王魁研究员团队在Nature Communications在线发表了题为“FBXO7 ubiquitinates PRMT1 to suppress serine synthesis and tumor growth in hepatocellular carcinoma”的论文,揭示了E3泛素连接酶FBXO7通过促进PRMT1泛素化降解抑制丝氨酸代谢和肝癌生长的分子机制。同时,这项研究被Nature Communications接收后,团队应Nature Research Cancer Community邀请在“Behind the paper”专栏撰文分享了该研究背后的故事(https://communities.springernature.com/posts/fbxo7-ubiquitinates-prmt1-to-suppress-phgdh-arginine-methylation-serine-synthesis-and-tumor-growth-in-hepatocellular-carcinoma)。

代谢异常是肿瘤细胞的重要特征之一,与肿瘤发生发展密切相关,是肿瘤治疗的潜在靶点。其中,丝氨酸从头合成途径是糖酵解代谢的关键代谢旁路,通过PHGDH等数个代谢酶的催化作用将糖酵解中间产物3-磷酸甘油酸转化为丝氨酸和甘氨酸,进而介导一碳代谢,为肿瘤细胞快速增殖提供物质和能量基础,同时产生还原力维持肿瘤细胞内氧化还原稳态。我们前期研究发现,PHGDH在肝癌中显著下调,但其酶活却由于PRMT1介导的精氨酸甲基化而代偿性增强,通过加速丝氨酸代谢缓解氧化应激压力,促进肝癌生长(Wang Ket al.,Nat Commun. 2023;14(1):1011,doi: 10.1038/s41467-023-36708-5)。然而,PRMT1在肝癌中表达上调的机制仍不清楚。
为了探究PRMT1在肝癌中表达上调的分子机制,本研究利用生信分析结合相互作用蛋白质组学研究,发现E3泛素连接酶FBXO7是PRMT1的潜在互作蛋白。通过免疫共沉淀和GST pulldown实验发现FBXO7可与PRMT1直接互作,并通过构建截短突变明确了各自互作的关键结构域。进一步研究发现,FBXO7可介导PRMT1第37位赖氨酸泛素化修饰和蛋白酶体降解,从而降低PHGDH的精氨酸甲基化水平,抑制丝氨酸合成,诱导氧化应激,在体内外抑制肝癌细胞生长。通过分析临床肝癌和癌旁组织样本,研究人员发现FBXO7在肝癌中低表达,且与PRMT1蛋白水平以及PHGDH精氨酸甲基化水平显著负相关。
综上,本研究揭示了FBXO7-PRMT1-PHGDH轴调控肝癌丝氨酸代谢的新机制,可为靶向丝氨酸代谢的肿瘤治疗策略提供新思路。
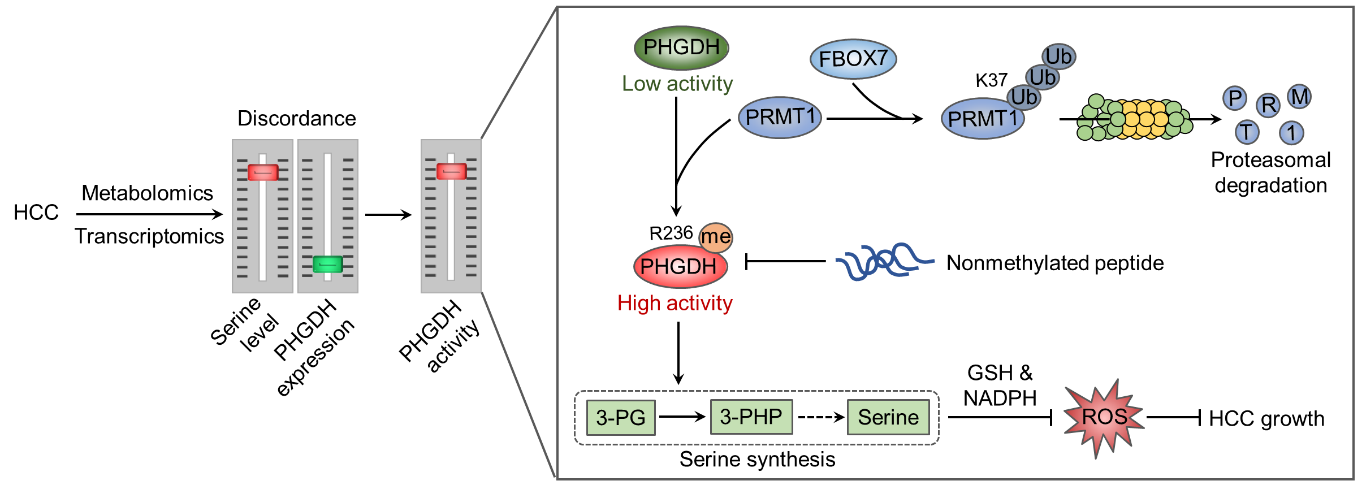 图1. FBXO7-PRMT1-PHGDH轴调控肝癌丝氨酸代谢的分子机制
图1. FBXO7-PRMT1-PHGDH轴调控肝癌丝氨酸代谢的分子机制
四川大学红足一1世平台王魁研究员、华西公共卫生学院/华西第四医院蒋静文副研究员为本论文的共同通论作者,华西第二医院罗丽副主任技师、红足一1世平台硕士研究生吴星云、樊佳武为本论文的共同第一作者。
原文链接:https://www.nature.com/articles/s41467-024-49087-2